الذرة
من ويكيبيديا، الموسوعة الحرة
هذه المقالة عن الذرة، وحدة بناء المادة.
Disambig gray RTL.svg
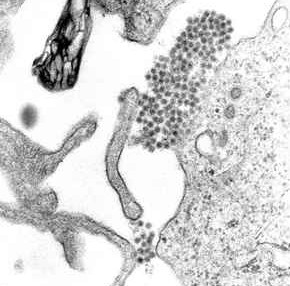
ذرة هيليوم
ملف:Helium atom QM.svg
رسم توضيحي لذرة الهيليوم، يصور النواة (بالوردي) وتوزيع السحابة الإلكترونية (بالأسود). النواة (أعلى اليمين) في الهليوم-4 في الواقع متماثلة كرويًا وتشبه إلى حد كبير السحابة الإلكترونية، على الرغم من أن الأنوية أكثر تعقيدًا وهذا ليس الحال دائما. الشريط الأسود هو أنغستروم واحد (10−10 م أو 100 بيكومتر).
تعريف
أصغر قسم معترف به من العنصر الكيميائي
الخصائص
الوزن الشامل:
1.67×10−27 إلى 4.52×10−25 كـg
الشحنة الكهربية:
صفر (طبيعية), أو شحنة أيون
نطاق القطر:
62 بيكومتر (He) إلى 520 بيكومتر (Cs) (صفحة بيانات)
المكونات:
إلكترونات وما يوافقها في النواة من البروتونات إلى جانب النيوترونات
الذرة هي أصغر حجر بناءٍ أو أصغر جزء من العنصر الكيميائي يمكن الوصول إليه والذي يحتفظ بالخصائص الكيميائية لذلك العنصر. يرجع أصل الكلمة الإنجليزية (بالإنجليزية: Atom) إلى الكلمة الإغريقية أتوموس، والتي تعني غير القابل للانقسام؛ إذ كان يعتقد أنه ليس ثمة ما هو أصغر من الذرة.
تتكون الذرة من سحابة من الشحنات السالبة (الإلكترونات) التي تدور حول نواة موجبة الشحنة صغيرة جدًا في المركز، وتتكون النواة من بروتونات موجبة الشحنة، ونيوترونات متعادلة، وتعدّ الذرة هي أصغر جزء من العنصر يمكن أن يتميز به عن بقية العناصر؛ إذ كلما غصنا أكثر في المادة لنلاقي البنى الأصغر لن يعود هناك فرق بين عنصر وآخر. فمثلاً، لا فرق بين بروتون في ذرة حديد وبروتون آخر في ذرة يورانيوم مثلًا، أو ذرة أي عنصرٍ آخر. الذرة، بما تحمله من خصائص؛ عدد بروتوناتها، كتلتها، توزيعها الإلكتروني... تصنع الفروقات بين العناصر المختلفة، وبين الصور المختلفة للعنصر نفسه (المسماة بالنظائر)، وحتى بين كَون هذا العنصر قادرًا على خوض تفاعل كيميائي ما أم لا.
ظل وما زال تركيب الذرة وما يجري في هذا العالم البالغ الصغر يشغل العلماء ويدفعهم إلى اكتشاف المزيد. ومن هنا أخذت تظهر فروع جديدة في العلم حاملة معها مبادئها ونظرياتها الخاصة بها، بدءًا بمبدأ عدم التأكد (اللاثقة)، مرورًا بنظريات التوحيد الكبرى، وانتهاءً بنظرية الأوتار الفائقة. الذرة اصغر من الجزيء ويمكن لذرتين أو أكثر تكوين جزيء.
محتويات
1 النظرية الذرية
1.1 نموذج دالتون
1.2 نموذج فاراداي
1.3 نموذج طومسون
1.4 نموذج رذرفورد
1.5 نموذج بور
1.6 النموذج الذري الحديث
2 تفسير ميكانيكا الكم للتركيب الإلكتروني للذرة
3 الانشطار النووي
4 مكونات الذرة
4.1 الجسيمات ما تحت الذرية
4.2 خصائص الذرة
4.3 الخواص النووية
4.4 النماذج النووية
4.4.1 نموذج القطرة السائلة
4.4.2 طاقة الربط الحجمية
4.4.3 الطاقة السطحية
4.4.4 طاقة التنافر الكهربائي
4.4.5 طاقة الشفاعية
5 حجم الذرة
6 العناصر والنظائر
7 التكافؤ والترابط
8 الذرات في الكون والكرة الأرضية
9 الذرة في الصناعة
10 الذرة في العلم
11 الذرة تاريخياً
11.1 النظريات التاريخية
11.2 أصل تسمية الذرة
12 الترميز
13 المصادر
14 اقرأ أيضًا
النظرية الذرية
المقالة الرئيسة: نظرية ذرية

الرمز النمطي للذرة.
النظرية الذرية تهتم بدراسة طبيعة المادة، وتنص على أن كل المواد تتكون من ذرات. الاكتشافات اليونانية في عام 430 ق.م توصل الفيلسوف اليونانى (ديموقريطس) إلى مفهوم أو فكرة في كل الأشياء مصنوعة من ذرات أو بالمعنى الحرفى كل الأشياء مكونة من ذرات غير قابلة للانقسام. واعتقد هذا الفيلسوف أن كل الذرات متماثلة وصلبة وغير قابلة للانضغاط إلى جانب أنها غير قابلة للانقسام، وأن الذرات تتحرك بأعداد لا حصر لها في فضاء فارغ.وأن الاختلاف في الشكل والحجم الذرى يحدد الخصائص المختلفة لكل مادة. وطبقاً لفلسفة (ديموقريطس) فإن الذرات ليست المكون الأساسي للمواد فقط ولكنها تكون أيضاً خصائص النفس الإنسانية. فعلى سبيل المثال فإن الآلام تسببها «الذرات الشريرة» وذلك لأن هذه الذرات تكون على شكل (إبر) بينما يتكون اللون الفاتح من الذرات المسطحة ذات الملمس الناعم، وقد اعتقد ديمقريطس واعتقد معه الناس أفكار هي بلا شك تثير تهكمنا الآن ولكنها كانت منذ قرون «العلم الذي لا يبارى». إن النظرية اليونانية عن الذرة لها مدلول تاريخي وفلسفى بالغ الأهمية، إلا أنها ليست ذات قيمة علمية، ذلك أنها لم تقم على أساس ملاحظة الطبيعة أو القياس أو الاختبارات أو التجارب.
نموذج دالتون
وجاءت نظرية دالتون بشكل مختلف عما سبق ذلك كونها تعتمد على قوانين بقاء الكتلة والنسب الثابتة والتي اشتقت من العديد من الاستنتاجات المباشرة.
يمكن التعبير عن النظرية التي اقترحها بالاتي:
الأشياء (المواد) تتكون من العديد من الجسيمات الغير قابلة للتجزئة (ذرات) ذات حجم صغير جداً.
ذرات نفس العنصر متشابهة في الخواص (الشكل، الحجم، الكتلة)، وتختلف تماماً عن ذرات العناصر الأخرى.
الذرة مصمتة متناهية الصغر، غير قابلة للتجزئة
يمكن لذرات العناصر المختلفة أن تتحد مع بعضها بنسب عددية بسيطة مكونة المواد.
الاتحاد الكيميائي عبارة عن تغيير في توزيع الذرات.
وعندما سأل دالتون عن شكل الذرة قال إنها دائرية الشكل ومضغوطة بحيث لايستطيع أي شيء اختراقها.
لقد أثبتت نظرية دالتون نجاحها من خلال تفسيرها لبعض الحقائق القائمة في ذلك الزمان كما أنها استطاعت أيضا التنبؤ ببعض القوانين الغير مكتشفة:
تفسر هذه النظرية (قانون النسب الثابتة): افترض دالتون ان مادة ما تتكون من عنصرين A و B. وان أي جزيئي من هذه المادة يتكون من ذرة واحدة من A وذرة واحدة من B يعرف الجزيء بأنه مجموعة ذرات مترابطة مع بعضها بقوة تسمح لها بالتصرف أو إعادة التنظيم كجسيم واحد. افترض أيضا ان كتلة الذرة A تكون ضعف كتلة الذرة B وبالتالى فان الذرة A تساهم بضعف الكتلة التي تساهم بها الذرة B في تكوين جزيء واحد من هذه المادة الأمر الذي يعني ان نسبة كتلة الذرة Aالى الذرة B هي 2/1. في مركب الماء نسبة الهيدروجين إلى الأكسجين دائماً ثابتة:
2.00g H /16.00g O=1.00g H / 8.00g O
لقد تنبأت نظرية دالتون بقانون النسب المتضاعفة (قانون النسب المتعددة): عندما تتحدد ذرة ما مع أخرى وتشكل أكثر من مركب فإن نسبة الأوزان لتلك الذرة التي تتحد مع واحد جرام من الذرة الأخرى يجب أن يكون نسبة بسيطة.
نموذج فاراداي
توصّل فاراداي إلى أن الذرات تحتوي على جسيمات مكهربة تدعى إلكترونات وقام بتجارب تحليل أملاح إلا أنه لم يضع أي نموذج ذري.
نموذج طومسون
نموذج طومسون، الشحنة الموجبة موزعة بالتساوي على كل الحجم المشغول بالإلكترونات.
في عام 1896م أجرى جوزيف جون طومسون أبحاثاً حول خواص أشعة الكاثود. وفي 30 أبريل 1897م، أدهش الأوساط العلمية بإعلانه عن أن الجسيمات المكونة لأشعة الكاثود هي أصغر حجماً بكثير من الذرات، وقد سمى هذه الجسيمات بالإلكترونات.
وفى عام 1897م أظهر اكتشاف الإلكترون للعالم «طومسون» أن المفهوم القديم عن الذرة منذ ألفى عام، والذي ينطوى على أنها جسيم غير قابل للانقسام كان مفهوماً خاطئاً، كما أظهر أيضاً أن للذرة - في الواقع- ترتيب معقد غير أنهم لم يغيروا مصطلح «الذرة» أو الغير قابله للتجزئة إلى «اللا ذرة» وأدى اكتشاف «طومسون» عن الإلكترون ذو الشحنة السالبة إلى إثارة الإشكاليات النظرية لدى الفيزيائيين لأن الذرات ككل - تحمل شحنات كهربائية متعادلة فأين الشحنة الموجبة التي تعادل شحنة الإلكترون.
وفى الفترة ما بين عامى (1903 - 1907) حاول «طومسون» أن يحل هذا اللغز السابق الذي ذكره عن طريق تكييف نموذج للذرة والتي اقترحها في المقام الأول «اللورد كيلفن» في عام 1902، وطبقاً لهذا النموذج والذي يشار إليه غالباً بنموذج «كرة معجونة وبها بعض حبوب الزبيب» فإن الذرة غالباً هنا عبارة عن كرة ذات شحنة موجبة متماثلة أما الشحنات السالبة (الإلكترونات) فهي تتوزع داخل تلك الشحنة الموجبة مثل الزبيب المدفون في كرة معجونة.
وترجع أفضلية نظرية «طومسون» عن الذرة في أنها ثابتة، فإذا لم توضع الإلكترونات في مكانها الصحيح فستحاول أن تعود إلى مواضعها الأصلية ثانية. وفى نموذج معاصر أيضاً نظر العلماء إلى الذرة على أنها مثل النظام الشمسي أو مثل كوكب «زحل» ذو حلقات من الإلكترونات محيطة بالشحنة الكهربية الإيجابية المركزة.
حيث توصل طومسون إلى أن:
الذرة كرة مصمتة من الشحنات الموجبة.
تتخلل الالكترونات السالبة الذرة (كما تتخلل البذور ثمرة البرتقال).
الذرة متعادلة كهربائياً.
كان عمل طومسون يمثل تقدماً أساسياً في مجال الفهم العلمي لبنية الذرة مقترحاً نموذجاً عرف فيما بعد بنموذج طومسون. إن عمله هذا أعطى الكثير من البراهين العملية لكثير من النظريات التي وضعت حول البنية الذرية في عصره.
نموذج رذرفورد
اكتشف رذرفورد من خلال تجاربه بأن الشحنة الموجبة للذرة تتركز في مركزها في نواة صغيرة مكثفة ومتراصة وعلى أساس ذلك وضع نموذجه الذري الذي عرف بالنموذج النووي. افترض رذرفورد عام 1911م النموذج النووي للذرة معتبراً أن الذرة تتكون من كتلة صغيرة جداً وكثيفة جداً ذات شحنة موجبة تسمى النواة وتحتل مركز الذرة وتحتوي نواة الذرة على جميع البروتونات ولذا فان كتلة الذرة هي تعبير عن مجموع كتل البروتونات في نواتها (حيث أن قيمة كتل الإلكترونات صغيرة جداً…. فهي قيم مهملة). كما أن شحنة النواة الموجبة ترجع إلى تمركز البروتونات الموجبة بها. وتتوزع الالكترونات في الذرة حول النواة بنفس الطريقة التي تتوزع بها الأجرام السماوية حول الشمس. وبما أن الذرة متعادلة لذا فعدد الالكترونات يساوي عدد البروتونات بالنواة.
قام العالم رذرفورد بإجراء بعض من أبرز التجارب للوصول إلى حقائق تركيب الذرة. وقد اعتمد في تجارية على استخدام جسيمات ألفا المنطلقة من مادة مشعة. وكان في اعتقاده أن المادة المشعة تطلق إشعاعاتها في كافة الاتجاهات وبلا حدود وهي تتكون من جسيمات ألفا (α-particles) الموجبة الشحنة وجسيمات بيتا (β-particles) السالبة الشحنة وأشعة غاما (γ-rays) المتعادلة الشحنة. ويمكن اعتبار جسيمات ألفا على أنها ذرات الهليوم فــُقد منها إليكترونين، ولذا فإن جسيمات ألفا تحمل شحنتين موجبتين ولها كتلة تساوي أربعة مرات كتلة ذرة الهيدروجين. وقد ساعد «رذر فورد» على تنمية معرفتنا بالذرة، عندما قام مع «هانز جايجر» بإجراء تجارب رقائق الذهب الشهيرة والتي أظهرت أن للذرة نواة صغيرة ولكنها تحتوى على كل الكتلة تقريباً. فقد قام بإطلاق جسيمات «ألفا» خلال الرقائق الذهبية ثم استقبلت هذه الجسيمات كومضات ضوئية خلف رقيقة الذهب.
لقد سمح رذرفورد بإطلاق حزمة رقيقة للغاية من جسيمات ألفا من مصدر مشع كعنصر الراديوم بالمرور في اتجاه صفيحة معدنية رقيقة من الفضة أو الذهب. وبعد اختراق تلك الجسيمات الصفيحة المعدنية استقبلها على لوح من كبرتيد الخارصين موضوع خلفها وكانت النتائج: قام رذرفورد عمليا بإطلاق جسيمات «ألفا» خلال الرقائق الذهبية تصل سماكة الرقيقة الذهبية الواحدة إلى حوالى 0.00004 سنتيمتر فقط، ثم استقبل هذه الجسيمات كومضات ضوئية على شاشة الاستقبال ومرت معظم الجسيمات مباشرة عبر الشريحة في حين انحرفت واحدة فقط من عشرين ألف جسيم (ألفا) إلى حوالى 45ْ م أو أكثر.
هذه التجربة شكلت ثورة علمية في المفهوم الذري وقتها وكانت الطريقة الوحيدة لقبول واستيعاب نتائج هذه التجربة هي فيما استطاع رذرفورد تفسيره على أن كامل كتلة الذرة تقريبا مجتمعة في المركز وتمتلك هذه النواة حجما صغيراً جداً مقارنة بحجم الذرة الكلية وقد توصل رذرفورد نتيجة ذلك إلى القول ((من خلال التفكير والدراسة أدركت أن هذا الارتداد المتفرق هي نتيجة حتمية للتصادم الفردى فعندما قمت بالعد وجدت أنه من المستحيل أن أحصل على أي نتيجة ولهذا العدد الضخم، إلا إذا أخذت نظام يكون الجزء الأكبر من الكتلة من الذرة فيه مركزا بالنواة الدقيقة. وبعد كل هذا التحليل أستطيع القول بأننى قد توصلت إلى وجود ذرة ذات مركز دقيق جداً به أغلب الكتلة ويحمل شحنة موجبة تعادل شحنة الإلكترون.)). إن الطريقة الوحيدة التي مكنت رذرفورد من تفسير نتائج تجربته المدهشة وقدرة الجسيمات على المرور والانحراف في داخل الذرة هي الاستنتاجات بأن:
أولاً: وجود فراغ كبير في الذرة دليل على عدم الانحراف لمعظم الجسيمات.
ثانياً: احتواء الذرة بعض الجسيمات الثقيلة والمشحونة بشحنات موجبة وبالتالي فإن اقتراب جسيمات ألفا من هذه الجسيمات الموجبة قد تسبب في تنافر بسيط معها، وبالتالي كان سببا في انحراف بعض جسيمات ألفا.
ثالثاً: تمركز الجسيمات الموجبة الشحنة بالذرة في وسطها مما سبب الانحراف الكلى لجسيمات ألفا (قليلة العدد نظراً لصغر حجم الفراغ الذي تشغله النواة) المارة بمركز النواة. مما سبب الانحراف الكبير لهذه الجسيمات.
نموذج رذرفورد للذرة عام 1911م:
الذرة تشبه المجموعة الشمسية (نواة مركزية يدور حولها على مسافات شاسعة الالكترونات سالبة الشحنة).
الذرة معظمها فراغ (لأن الذرة ليست مصمتة وحجم النواة صغير جدا بالنسبة لحجم الذرة).
تتركز كتلة الذرة في النواة (لأن كتلة الالكترونات صغيرة جدا مقارنة بكتلة النواة).
يوجد بالذرة نوعان من الشحنة (شحنة موجبة بالنواة وشحنات سالبة على الالكترونات).
الذرة متعادلة كهربيا لأن عدد الشحنات الموجبة يساوي عدد الشحنات السالبة (الالكترونات).
تدور الالكترونات حول النواة في مدارات خاصة.
يرجع ثبات الذرة إلى وقوع الالكترونات تحت تأثير قوتين متضادتين في الاتجاه متساويتين في المقدار هما قوة جذب النواة للالكترونات وقوة الطرد المركزي الناشئة عن دوران الالكترونات حول النواة.
تناقضات نموذج رذرفورد الذري مع قوانين الكهرومغناطيسية:
اولاً: بتطبيق قوانين الكهرومغناطيسية على نموذج رذرفورد فإن الذرة ليست متزنة ميكانيكياً حيث أن النواة الموجبة تقوم بجذب الالكترونات السالبة التي تدور حول النواة في مسار دائري تنشأ قوة مركزية تساوي (ك ع2 / نق) وبالتالي يتحرك الإلكترون بتسارع مركزي ويكون مع النواة ثنائي متذبذب فيشع أمواجاً كهرومغناطيسية مستمرة فيفقد الإلكترون طاقته تدريجياً ليدور في مسار حلزوني إلى أن يسقط في النواة.
ثانياً: بما أن الإلكترون يدور حول النواة ويكون معها زوجاً متذبذباً إذاً الذرة تشع طيف مستمر يغطي جميع الترددات والأطوال الموجية وهذا يناقض التجارب العملية التي أثبتت أن كل نوع من الذرات تشع طيفاً خطياً له طول موجي محدد بدقــة خاص بها.
نموذج بور

نموذج بور للذرة : نموذج دوران الإلكترونات في مدارات محددة حول النواة تشبه مدارات كواكب المجموعة الشمسية.
في عام 1913م اقترح الفيزيائي الدانماركي نيلز بور نموذجًا للذرة اعتمد فيه على فروض نموذج رذرفورد. ويقترح بور أن كل إلكترون يدور حول النواة ليس في مدارات إلكترونية بالمعنى التقليدي، وإنما يكون لكل مدار طاقة محددة وثابتة، وبالتالي فإن الإلكترونات تدور حول النواة في مستويات طاقة مساوية لطاقة الإلكترون فعند إعطاء الإلكترون كمية من الطاقة (كالتسخين مثلاً) عندئذ يكتسب الإلكترون طاقة إضافية وينتقل من مستوى طاقته إلى مستوى طاقة أكبر ويكون الفرق بين طاقتي المستويين مساوي للطاقة التي اكتسبها الإلكترون وبعد مرور فترة زمنية متناهيه في الصغر تقدر بجزء من مائة مليون جزء من الثانية يفقد الإلكترون طاقته المكتسبة على شكل إشعاع ضوئي. وقد أطلق بور على عملية انتقال الإلكترون من مستوى الطاقة الكبير إلى مستوى الطاقة الأقل بقفزة الكم للإلكترون، والكم هي كمية الطاقة التي يطلها الإلكترون عند انتقاله من مسوى عال من الطاقة إلى مستوى أقل منه وهي كمية طاقة صغيرة جدا جدا؛ وهي طاقة الشعاع الضوئي الذي انطلق من الإلكترون، وسميت بعد ذلك فوتون. وقد نجح بور بهذا الافتراض أن يفسر الترددات والأطوال الموجية المحددة للطيف الخطي المنبعث من الذرات.
ولقد ساعد نموذج بور للذرة على تفسير الكيفية التي تتفاعل بها الذرات مع الضوء والأشكال الأخرى للإشعاع. فقد افترض بور أن إمتصاص وإنبعاث (إطلاق) الضوء من الذرة يستلزم تغييرًا في موضع وطاقة الإلكترون فيقفز من مستوى لآخر. وقد استطاع الكيميائيون الحصول على الكثير من المعلومات حول تركيب الجزيئات عن طريق قياس كمية الإشعاع التي تمتصها والتي تنبعث منها.
فروض نيلز بور في نموذجه الذري عام 1913م:
الإلكترونات تدور حول النواة في مستويات طاقة لها طاقات ثابتة ومحددة.
كل مستوى طاقة له طاقة محددة وثابتة يعبر عنها بأرقام صحيحة من 1-7 سميت بالأعداد الكمية الرئيسية.
الفراغ الموجود بين مستويات الطاقة حول النواة هي مناطق محرمة على الإلكترونات التواجد بها.
4- لا يفقد الإلكترون أي طاقة طالما ظل في مستوى طاقته فإذا اكتسب طاقة تسمى طيف امتصاص. فسينتقل إلى مستوى طاقة اعلى ولكن سرعان ما سيفقد الطاقة المكتسبة ويطلقها على شكل شعاع ضوئي يسمى طيف انبعاث.
النموذج الذري الحديث
تتكون الذرة من نواة تحتوي على الشحنة الموجبة (بروتونات) تتركز فيها معظم الكتلة محاطة بإلكترونات سالبة الشحنة تتحرك بسرعة كبيرة ولها خواص الموجات بموجب معادلة رياضية وموجودة في فراغ حول النواة يكون احتمال وجودها فيه أكثر من 90% تسمى المجالات الإلكترونية.
تفسير ميكانيكا الكم للتركيب الإلكتروني للذرة
تتكون الذرة من سحابة من الشحنات السالبة (الإلكترونات) تحوم حول نواة موجبة الشحنة صغيرة جدا في المركز. تتكون النواة الموجبة من بروتونات موجبة الشحنة، ونيوترونات متعادلة. الذرة هي أصغر جزء من العنصر يمكن أن يتميز به عن بقية العناصر؛ إذ كلما غصنا أكثر في المادة لنلاقي البنى الأصغر لن يعود هناك فرق بين عنصر وآخر. فمثلاً، لا فرق بين بروتون في ذرة حديد وبروتون آخر في ذرة يورانيوم مثلاً، أو ذرة أي عنصر آخر. الذرة، بما تحمله من خصائص؛ عدد بروتوناتها، كتلتها، توزيعها الإلكتروني... تحدد الفروق بين خصائص العناصر المختلفة، وكذلك تحديد قابلية عنصر ما لدخول تفاعل كيميائي من عدمه، أما بالنسبة لتساوي عدد البروتونات في أنوية واختلاف أعداد النيوترونات فهو مايسمي بنظائر العنصر الواحد. ظل تركيب الذرة وما يجري في هذا العالم البالغ الصغر، ظل وما زال يشغل العلماء ويدفعهم إلى اكتشاف المزيد. ومن هنا أخذت تظهر فروع جديدة في العلم حاملة معها مبادئها ونظرياتها الخاصة بها، بدءاً من مبدأ عدم التأكد، مروراً بنظريات التوحيد الكبرى، وانتهاءً بنظرية الأوتار الفائقة. أكثر النظريات التي لاقت قبولا لتفسير تركيب الذرة هي النظرية الموجية. وهذا التصور مبني على تصور نيلز بور مع الأخذ في الاعتبار الاكتشافات الحديثة والتطويرات في ميكانيكا الكم. و التي تنص على:
تتكون الذرة من جسيمات تحت ذرية (البروتونات، الإلكترونات، النيوترونات).
مع العلم بأن معظم حجم الذرة يحتوى على فراغ.
في مركز الذرة توجد نواة موجبة الشحنة تتكون من البروتونات، النيوترونات (ويعرفوا على أنهم نويات)
النواة أصغر 100,000 مرة من الذرة. فلو أننا تخيلنا أن الذرة بإتساع مطار هيثرو فإن النواة ستكون في حجم كرة الجولف
في عام 1926م وضع العالم النمساوي ارفين شرودنجر معادلته الموجية التي تحمل اسمه، وعندما تم تطبيق المعادلة على ذرة الهيدروجين تبين أن حركة الإلكترون حول النواة تشبه السحابة واستبدل شرودنجر مفهوم المدار الإلكتروني بالأوربيتال ليتم وضع نموذج أكثر موضوعية للتركيب الإلكتروني للذرة:
معظم الفراغ الذري يتم شغله بالأوربيتالات التي تحتوى على الإلكترونات في شكل إلكترونى محدد.
كل أوربيتال يتسع لعدد 2 إلكترون، محكومين بثلاث أرقام كمية: عدد الكم الرئيسي وعدد الكم الثانوي وعدد الكم المغناطيسي.
كل إلكترون في أي من الأوربيتالات له قيمة واحدة لعدد الكم الرابع والذي يسمى عدد الكم المغزلي.
الأوربيتالات ليست ثابتة ومحددة في الاتجاه وإنما هي تمثل احتمالية تواجد 2 إلكترون لهم نفس الثلاث أعداد الكمية الأولى، وتكون آخر حدود هذا الأوربيتال هي المناطق التي يقل تواجد الإلكترون فيها عن 90%.
تميل الإلكترونات إلى أن تشغل أقل مستويات الطاقة في الذرة، والذي تكون المدارات فيه قريبة للنواة (مستوى الطاقة الأول). وتكون الإلكترونات الموجودة في المدارات الخارجية (مدار التكافؤ) هي المسئولة عن الروابط الكيميائية المختلفة بين الذرات.... لمزيد من التفاصيل راجع التكافؤ والترابط
الانشطار النووي
المقالة الرئيسة: انشطار نووي

الإنشطار النووي المتسلسل.
كان إنريكو فيرمي أول من قام بتصويب النيوترونات على اليورانيوم عام 1934 ولكنه لم ينجح في تفسير النتائج. وقام العالم الكيميائي الألماني أوتو هان وزميلته ليز مايتنر وزميلهما شتراسمان بتلك الأبحاث وقاموا بتحليل المواد الناتجة عن التفاعل. وكانت مفاجأة لم يستطيعوا أولا تفسيرها إذ أنهم وجدوا عناصر جديدة تكونت من خلال التفاعل. وكان أن أعادوا التجربة باستخدام يورانيوم عالي النقاء، فكانت النتيجة هي ما وجدوه من قبل وتكوّن عنصر الباريوم، والباريوم عدده الذري تقريباً نصف العدد الذري لليورانيوم. كان ذلك عام 1938 وبعدها بدأت الحرب العالمية الثانية واضطرت ليزا مايتنر مغادرة ألمانيا نظرا لاضطهاد النازية لليهود. وسافرت ليزا إلى السويد حيث كان أحد أقربائها يعمل هناك وهو روبرت فريتش. وقصت عليه نتائج تجربة اليورانيوم.
وفي مطلع عام 1939 فطن العالم أتوهان وشتراسمان إلى تفسير التفاعل الذي حدث وانه انشطار لنواة ذرة اليورانيوم وتكون الباريوم ونشر نتيجة ابحاثه في المجلة العلمية. وفي نفس الوقت استطاعت مايتنر بمساعدة فريتش على تفسير تجربة اليورانيوم بأنها انشطار نووي ن واستطاعا الاثنان تكملة التفسير بأنه من خلال انقسام نواة اليورانيوم يحدث فقدا في الكتلة بين كتلة اليورانيوم وكتلتي الباريوم والكريبتون الناتجة عن الانقسام، وقدرا تلك الكتلة المفقودة بأنها نحو 1/5 من كتلة البروتون، أي أن طاقة تقدر بنحو 200 MeV تتحرر من كل انقسام. وهي طاقة بالغة للغاية. وسافرا الأثنان بعد ذلك إلى الولايات المتحدة واجتمعا مع أينشتاين وقصا عليه نتيجة أبحاثهما.
وكانت مجموعة من العلماء تعمل في فرنسا تحت رئاسة فريدريك كوري زوج ماري كوري- مكتشفة البولونيوم - واكتشفوا أنه خلال انشطار نواة اليورانيوم ينطلق عدد من النيوترونات قدروه 3.5 في المتوسط إلا أنهم عدّلوا ذلك العدد إلى 2.6 نيوترونات في المتوسط لكل انشطار فيما بعد.
ولما عرف أينشتاين وزميله زيلارد بأمريكا نتائج مايتنر وفريتش بالإضافة إلي نتائج المجموعة الفرنسية عن النيوترونات المصاحبة للانشطار قام أينشتاين وزيلارد بتوجيه خطابا إلى الرئيس الأمريكي آنذاك روزفيلت يعرفوه بتلك النتائج العلمية الخطيرة والتحذير من إمكانية سعي الألمان باستغلال تلك المعلومات لصنع قنبلة ذرية يكون لها مفعولا فظيعا، خصوصا وأن الحرب قد بدأت في أوروبا بهجوم الألمان على بولندا. ووصل خطاب أينشتاين وزيلاد إلى الرئيس الأمريكي في يناير 1939.
مكونات الذرة
الجسيمات ما تحت الذرية
على الرغم من أن كلمة ATOM تدل أصلا على الأجزاء التي لا يمكن أن تنقسم إلى أجزاء أصغر، ولكن إكتشفت التجارب العملية أن الذرة تتكون من جسيمات تحت ذرية مختلفة. الجسيمات المكونة للذرة هي الإلكترون، والبروتون والنيوترون، الإلكترون هو أقل كتلة من البروتون والنيوترون بكثير حيث تبلغ كتلته 9,11 × 10−31 كجم، مع شحنة أولية (سالبة) تساوي 1.6 × 10−19 كولوم، بروتونات، ونيوترونات التي تتكون بدورها من الكواركات التي تعد أصغر جزء من المادة، عدد البورتونات في نواة الذرة يطلق عليه العدد الذري، ويحدد أي عنصر له هذه الذرة. فمثلاً النواة التي بها بروتون واحد (أي النواة الوحيدة التي يمكن أن لا يكون بها نيوترونات) من مكونات ذرة الهيدروجين، والتي بها 6 بروتونات، ترجع للعنصر كربون، أو التي بها 8 بروتونات أكسجين. يحدد عدد النيورتونات نظائر العنصر. عدد النيوترونات والبروتونات متناسب، وفي النويات الصغيرة يكونا تقريبا متساويين، بينما يكون في النويات الثقيلة عدد كبير من النيوترونات. والرقمان معا يحددا النيوكليد (أحد أنواع النويات). البروتونات والنيوترونات لهما تقريبا نفس الكتلة، ويكون عدد الكتلة مساويا لمجموعهما معا، والذي يساوي تقريبا الكتلة الذرية. وكتلة الإلكترونات صغيرة بالمقارنة بكتلة النواة.
نصف قطر النوكليون (نيترون أو بروتون) يساوي 1 Fm (فيمتو متر = 10−15 متر). بينما نصف قطر النواة، والذي يمكن أن يكون تقريبا الجذر التربيعي لعدد الكتلة مضروبا في 1.2 fm، أقل من 0.01% من قطر الذرة. وعلى هذا تكون كثافة النواة أكثر من تريليون مرة (1012) من الذرة ككل. ويكون لواحد مللي متر مكعب من مادة النواة، كما لو كانت فيه كتلة 200,000 طن. النجم النيتروني يتكون من مثل هذا التصور.
وبالرغم من أن البروتونات الموجبة الشحنة يحدث بينها وبين بعضها تضاد كهرمغناطيسي، فإن المسافة بين النيوكلونات تكون صغيرة بدرجة كافية لأن يكون التجاذب القوي (والذي تكون أقوى من القوى الكهرمغناطيسية ولكن تقل بشدة مع بعد المسافة) غالب عليها. (وتكون قوى الجاذبية مهملة، لكونها أضعف (1036) من القوة الكهرومغناطيسية).
خصائص الذرة
أول خاصية هي العدد الذري وهو عدد البروتونات بالذرة
الخواص النووية
النماذج النووية
نحن بحاجة إلى الإجابة عن السؤال التالي:«ماذا يشبه التركيب الداخلي للنواة ؟» فتجارب التشتت تبين أن النواة ليست شيئا نقطيا بسيطة بل لها شحنة وكتلة موزعتين على حجمها لذلك فان النيوكلونات ما هي إلا حاملات لشحنة وكتلة يربطها نوع معين من التركيب الديناميكي.
نموذج القطرة السائلة
قدم نيلز بور في عام 1936 نموذج قطرة السائل للذرّة حيث اعتبر النيوكليونات كأنها جسيمات ضمن قطرة من سائل. اعتبر بور أن النيوكليونات تتفاعل بقوة مع بعضها البعض وتتعرض إلى تصادمات متكررة أثناء اهتزازها ضمن نواة الذرة، حيث تناظر حركة الاهتزاز هذه حركة الاضطراب الحرارية للجزيئات في قطرة سائل.
طاقة الربط الحجمية
، وهذه تبين أن القوة النووية A〉50 إن طاقة الترابط لكل نيوكليون تكون ثابتة تقريبا بالنسبة إلى على نيوكليون معين تكون بسبب القليل من اقرب الجيران فقط وليس بسبب كل نيوكليونات في النواة.إن طاقة الترابط الكلية للنواة تتناسب تناسبا طرديا مع А وبذلك تتناسب تناسب طردي Ev =av A : مع حجم النواة وتكون المساهمة إلى طاقة ترابط النواة بأكملها هي ثابت:av
الطاقة السطحية
البروتونات والنيوترونات الموجودة على سطح النواة (سطح الكرة)، اقل ارتباطا من الموجودة Es=-as Aداخل حجم الكرة⅔ ثابت معدل ثاني:as
طاقة التنافر الكهربائي
التنافر الكهروستاتيكي بين زوج من البروتونات في النواة يؤدي إلى نقصان الطاقة الرابطة بين الشغل اللازم لجلب بروتونات من اللانهاية إلى الحيز الذي هو من ضمنER النووية، طاقة كولوم متناسبة مع2 / (1−Ζ)Ζ عدد الأزواج البروتونية لنواة ERحجم النواة لذلك تكون الطاقة تحتوي علىZ من البروتونات وتتناسب تناسب عكسي مع نصف قطر النواة R=RO.A⅓ 0R: نصف قطر نواة الهيدروجين ER=−aR Z(Z−1) A−⅓ طاقة كولوم هي كمية سالبة لأنها ناشئة عن قوة معيقة لاستقرار النواة طاقة اللاتناظر: تعبر عن رغبة النوى لان تكون Ν=Ζ إذا إن هذه الطاقة ستكون مساوية للصفر للنوى التي يتساوى فيها عدد البروتونات مع عدد النيوترونات، ما عدا ذلك فهو موجب ويزداد بزيادة الحياد عن الشرط أعلاه، أي كلما كان ابعد عن الشرط كلما كانت الكتلة أكبر وطاقة الربط اصغر А⋿=−aA (A−2Z)2/A
طاقة الشفاعية
إن الانوية أكثر استقرارا تحتوي عددا زوجيا من البروتونات والنيوترونات، وان اقلها استقرارا هي التي تحتوي عددا فرديا من البروتونات والنيوترونات كما هو مبين في الجدول التالي
عدد الأنوية المستقرة
A
Z
N
166
زوجي
زوجي
زوجي
56
فردي
زوجي
فردي
51
زوجي
فردي
فردي
5*
فردي
فردي
زوجي
Ep=ap A−½ زوجيان 0 〈Ν ،Ζ apفردي+زوجي 0 = فرديان 0〉Z ،N
الطاقة الكلية لترابط النواة في نموذج القطرة السائلة يكتب على الشكل: EL=−[av A−as A⅔−aR Z(Z−1)A−⅓−aA (A−2Z)2/A+ap A−½]
إن تصور النواة كقطرة سائل متجانسة الشحنة وغير قابلة للانكباس، هو من أكثر النماذج شمولا، وتطبيقا وتفسيرا، خصوصا لظاهرة الانشطار النووي، يمكن تصورها اهتزاز قطرة سائل أو اعتبار أن هناك موجات تتحرك علي سطحه.
خط طيفي

طيف الهيدروجين المرئي من مجموعة خطوط بالمر. الخط H-ألفا هو الخط البرتقالي إلى اليمين ويتبعه ثلاثة خطوط في نطاق الضوء المرئي. والخطوط إلى اليسار فهي من الأشعة فوق البنفسجية حيث طول موجاتها أقصر من 400 نانومتر.

نموذج بور المبسط لذرة الهيدروجين. وتنشأ خطوط بالمر عندما يقفز الإلكترون ال1من أحد مستويات الطاقة العليا إلى مستوي الطاقة الثاني في الذرة. ويبين الشكل قفزة الإلكترون من مستوي الطاقة 3 إلى مستوي الطاقة 2، وعندما يفعل ذلك فإنه يصدر فوتونا يتبع الخط الطيفي H-ألفا، وهو أول مجموعة خطوط بالمر. بالنسبة للهيدروجين يكون العدد الذري ( Z = 1 {\displaystyle Z=1} {\displaystyle Z=1}) ولهذا فينتج عن تلك الانتقال فوتونا له طول موجة 656 نانومتر ولونه أحمر.
يتكون الطيف المرئي للهيدروجين من أربعة أطوال للموجة تقاس بالنانومتر وهي : 410 نانومتر، 434 نانومتر، و 486 نانومتر، و 656 نانومتر، وهي تعادل انبعاث فوتونات تصدرها الإلكترون عندما يهبط من مستوى طاقة عالية إلى مستوي طاقة أقل، ويكون المستوى الأقل هو عدد كم رئيسي n = 2.
- كما توجد لهذا الطيف عدد من الخطوط في نطاق الأشعة فوق البنفسجية، تقل طول موجتها عن 400 نانومتر ولذلك فهي لا ترى بالعين، وهي تنتمي أيضا لمجموعة بالمر.
حجم الذرة
لا يمكن تحديد حجم الذرة بسهولة حيث أن المدارات الإلكترونية ليست ثابتة ويتغير حجمها بدوران الإلكترون فيها. ولكن بالنسبة للذرات التي تكون في شكل بلـّورات صلبة، يمكن تحديد المسافة بين نواتين متجاورتين وبالتالى يمكن عمل حساب تقديري لحجم الذرة. والذرات التي لا تشكل بلـّورات صلبة يتم استخدام تقنيات أخرى تتضمن حسابات تقديرية. فمثلا حجم ذرة الهيدروجين تم حسابها تقريبيا على أنه 1.2× 10−10 م. بالمقارنة بحجم البروتون وهو الجسيم الوحيد في نواة ذرة الهيدروجين 0.87× 10−15 م. وعلى هذا فإن النسبة بين حجم ذرة الهيدروجين وحجم نواتها تقريبا 100,000.وتتغير أحجام ذرات العناصر المختلفة، ويرجع ذلك لأن العناصر التي لها شحنات موجبة أكبر في نواتها تقوم بجذب إلكترونات بقوة أكبر ناحية النواة.
العناصر والنظائر
كل عنصر، بمعنى ذرة كل عنصر، يحمل عدداً خاصاً به من البروتونات (يعرف بالعدد الذري)، وهذا العدد من البروتونات لا يشاركه به غيره من العناصر؛ فعنصر الصوديوم مثلاً يحمل أحد عشر بروتوناً، وفي حال قابلت عنصراً ما يحمل أحد عشر بروتوناً فكن على ثقة أنك أمام عنصر الصوديوم أو على الأقل أمام إحدى صوره.و تتشارك الذرات التي لها نفس العدد الذري في صفات فيزيائية كثيرة، وتتبع نفس السلوك في التفاعلات الكيميائية. ويتم ترتيب الأنواع المختلفة من العناصر في الجدول الدوري طبقا للزيادة في العدد الذري.
الكتلة الذرية بمفهومها البسيط هي مجموع كتل المكونات التي تحتويها الذرة؛ فهي تمثل مجموع كتل البروتونات والنيوترونات وكذلك الإلكترونات، لكن لأن كتلة الإلكترونات ضئيلة جداً فإنها تهمل، ويؤخذ بمجموع كتل البروتونات والنيوترونات.(من أجل تعريف الكتلة الذرية للعنصر انظر أدناه). تقاس الكتلة الذرية بوحدة الكتل الذرية amu (و.ك.ذ)، حيث تساوي كتلة البروتون 1 و.ك.ذ تقريباً، وكذا كتلة النيوترون. وبهذا بإمكاننا أن نقدر الكتلة الذرية لعنصر ما من خلال معرفتنا بعدد البروتونات (Z) وعدد النيوترونات (N) التي يتكون منها، وبمعرفة أن كتلة كل واحد من هذه الجسيمات النووية (النيوكليونات) تساوي وحدة كتلية ذرية واحدة، فإن كتلة الذرة تساوي مجموع أعداد البروتونات والنيوترونات مقدراً بوحدة الكتل الذرية.
مجموع أعداد البروتونات والنيوترونات يساوي عدد الكتلة (A). وهنا يمكننا أن نكتب العلاقة التالية: A = Z + N {\displaystyle A=Z+N} {\displaystyle A=Z+N}، حيث Z تشير إلى العدد الذري و N إلى عدد النيوترونات. قد يتواجد عنصر ما بصور مختلفة تسمى بالنظائر، إذ أنّ لكل نظير منها العدد الذري نفسه (أي أنها تمثل نفس العنصر)، لكنها تتفاوت في كتلها الذرية انطلاقا من الاختلاف في عدد النيوترونات فيما بينها. ولتمييز تلك النظائر فإنه يتم كتابة اسم العنصر متبوعامن 1 بروتون أيضا. ويكون الديوتيريوم هذا العنصر والموجودة في الطبيعة.
التكافؤ والترابط
تكون الذرات متعادلة كهربائياً عندما يكون عدد ما تحمله من شحنات موجبة (بروتونات) يساوي تماماً عدد ما تحويه من شحنات سالبة (إلكترونات). عندما تفقد الذرة أو تكسب الإلكترونات، فإنها تتحول إلى أيونات. عندما تكتسب الذرة الإلكترونات فإن شحنتها السالبة تفوق شحنتها الموجبة وبذا تتحول إلى أيون سالب لأن عدد الإلكترونات فيها أصبح أكثر من عدد البروتونات وعندما تفقد الذرة الإلكترونات، فإنها تتحول إلى أيون موجب لأن عدد البروتونات فيها أصبح أكثر من عدد الإلكترونات.
لا توجد الذرات في الطبيعة عادة بصورة حرة (باستثناء ذرات العناصر الخاملة)، وإنما توجد ضمن مركبات كيميائية متحدةً مع غيرها من الذرات سواء أكانت ذرات العنصر نفسه أو ذرات عناصر أخرى. فذرة الأكسجين مثلاً لا تتواجد عادة بصورة حرة، وإنما ترتبط أكسجين أخرى مكونة جزيء الأكسجين في الهواء الذي نستنشقه، وتتحد مع ذرتين من الهيدروجين مكونةً جزيء ماء، وهكذا.
سلوك الذرة الكيميائي يرجع في الأصل بصورة كبيرة للتفاعلات بين الإلكترونات. والإلكترونات الموجودة في الذرة تكون في توزيع إلكتروني محدد. وتقع الإلكترونات في أغلفة طاقة معينة طبقا لبعد تلك الأغلفة عن النواة (راجع "التركيب الذري"). ويطلق على الإلكترونات الموجودة في الغلاف الخارجي إلكترونات التكافؤ، والتي لها تأثير كبير على السلوك الكيميائي للذرة. والإلكترونات الداخلية تلعب دور أبضا ولكنه ثانوى نظرا لتأثير الشحنة الموجبة الموجودة في نواة الذرة.
كل غلاف من أغلفة الطاقة يتم ترتيبها تصاعديا بدأ من أقرب الاغلفة للنواة والذي يرقم برقم 1 ويمكن لكل غلاف أن يمتلئ بعدد معين من الإلكترونات طبقا لعدد المستويات الفرعية ونوع المدارات التي يحتويها هذا الغلاف :
الغلاف الأول : من 1 : 2 إلكترون - مستوى فرعى s - عدد 1 مدار. (حيث m= 0)
الغلاف الثاني : من 2 : 8 إلكترون - مستوى فرعى p، s - عدد 3 مدارات. (حيث m= -1. 0. +1)
الغلاف الثالث : من 3 : 18 إلكترون - مستوى فرعى d، p، s - عدد 5 مدارات. (حيث 2+. 1+. 0. m= -2. -1)
الغلاف الرابع : من 4 : 32 إلكترون - مستوى فرعى f، d، p، s - عدد 8 مدار. (حيث 3+. 2+. 1+. 0. m= -3. -2. -1)
يمكن تحديد كثافة الإلكترونات لأى غلاف طبقاً للمعادلة : 2 n2 حيث " n " هي رقم الغلاف، (عدد الكم الرئيسي) وتقوم الإلكترونات بملئ مستويات الطاقة القريبة من النواة أولا. ويكون الغلاف الخارجي الأخير الذي به الإلكترونات هو غلاف التكافؤ حتى لو كان يحتوى على إلكترون واحد.
وتفسير شغل أغلفة الطاقة الداخلية أولا هو أن مستويات طاقة الإلكترونات في الأغلفة القريبة من النواة تكون أقل بكثير من مستويات طاقة الإلكترونات في الأغلفة الخارجية. وعلى هذا لأنه في حالة وجود غلاف طاقة داخلى غير ممتلئ، يقوم الإلكترون الموجود في الغلاف الخارجى بالتنقل بسرعة للغلاف الداخى (ويقوم بإخراج إشعاع مساوى لفرق الطاقة بين الغلافين).
تقوم الإلكترونات الموجودة في غلاف الطاقة الخارجى بالتحكم في سلوك الذرة عند عمل الروابط الكيميائية. ولذا فإن الذرات التي لها نفس عدد الإلكترونات في غلاف الطاقة الخارجي (إلكترونات التكافؤ) يتم وضعها في مجموعة واحدة في الجدول الدوري. المجموعة هي عبارة عن عامود في الجدول الدوري، وتكون المجموعة الأولي هي التي تحتوى على إلكترون واحد في غلاف الطاقة الخارجي، المجموعة الثانية تحتوي على 2 إلكترون، المجموعة الثالثة تحتوي على 3 إلكترونات، وهكذا. وكقاعدة عامة، كلما قلت عدد الإلكترونات في مستوى في غلاف تكافؤ الذرة كلما زاد نشاط الذرة وعلى هذا تكون فلزات المجموعة الأولى أكثر العناصر نشاطا وأكثرها سيزيوم، روبديوم، فرنسيوم.
وتكون الذرة أكثر استقرارا (أقل في الطاقة) عندما يكون غلاف التكافؤ ممتلئ. ويمكن الوصول لهذا عن طريق الآتي: يمكن للذرة المساهمة بالإلكترونات مع ذرات متجاورة (رابطة تساهمية). أو يمكن لها أن تزيل الإلكترونات من الذرات الأخرى (رابطة أيونية). عملية تحريك الإلكترونات بين الذرات تجعل الذرات مرتبطة معا، ويعرف هذا بالترابط الكيميائي وعن طريق هذا الترابط يتم بناء الجزيئات والمركبات الأيوينة. وتوجد خمس أنواع رئيسية للروابط :
الرابطة الأيونية
الرابطة التساهمية
الرابطة التناسقية
الرابطة الهيدروجينية
الرابطة الفلزية
الذرات في الكون والكرة الأرضية
باستخدام نظرية التضخم الكوني، فإن عدد الذرات في الكون يتراوح من 4×1078 إلى 6×1079 تقريبا. وبصفة عامة نظرا لأن الكون لا نهائي فإن عدد الذرات أيضا يمكن أن يكون لا نهائي. وهذا لا يتنافى مع العدد الذي تم حسابه نظرا لأن الكون الخاضع للدراسة يقع ضمن 14 مليار سنة ضوئية.
الذرة في الصناعة
تقوم الذرة بدور غاية في الأهمية في الصناعة، يتضمن ذلك الصناعات النووية، علم المواد الصناعية، وأيضا في الصناعات الكيميائية، وبصفة خاصة في الإلكترونيات.
الذرة في العلم
ظلت الذرة محل أنظار تركيز العلماء لعقود. وكان للنظرية الذرية تأثير كبير على كثير من فروع العلم، مثل الفيزياء النووية، الطيف وكل فروع الكيمياء تقريبا. ويتم دراسة الذرة هذه الأيام في مجال ميكانيكا الكم والجسيمات تحت-الذرية.
و قد تمت دراسة الذرة بدون قصد مباشر في القرن 19 والقرن 20 وفي السنين الحالية، وبظهور تقنيات جديدة أصبحت دراسة الذرة أسهل وأدق. فبعد استخدام الميكروسكوب الإلكتروني الذي تم اكتشافه في عام 1931 تم تصوير ذرات مفردة. كما تم استحداث طرق جديدة للتعرف على الذرات والمركبات. فمثلا يتم استخدام مطياف الكتلة لتحديد أوزان الذرات والمركبات. كما يتم استخدام جي سي إم إس «كروماتوجرافي الغاز ومطياف الكتلة» لمعرفة المواد. وأيضا التعرف على البنية البلورية للمواد بواسطة أشعة إكس وكذلك بأجهزة حيود النيوترونات.
الذرة تاريخياً
النظريات التاريخية
قام كل من ديموقريطوس وليسيوبوس، «فلاسفة إغريق من القرن الخامس قبل الميلاد» بتقديم أول الافتراضات بخصوص الذرة. فقد افترضا أن لكل ذرة شكل محدد مثل الحصوات الصغيرة، وهذا الشكل هو ما يحكم خواص تلك الذرة. وقام دالتون في القرن 19 بإثبات أن المادة تتكون من ذرات ولكنه لم يعرف شيئا عن تركيبها. وقد كان هذا الفرض مضاد لنظرية الانقسام اللانهائي، التي كانت تنص على أن المادة يمكن أن تنقسم دائما إلى أجزاء أصغر.
وخلال هذا الوقت، كانت الذرة تعدّ أنها أصغر جزء في المادة، وقد تغير هذا الفرض لاحقا إلى أن الذرة نفسها تتكون من جسيمات تحت الذرية وتم اكتشاف الإلكترون عن طريق تجربة طومسون وكانت عن أول الجسيمات التي يتم اكتشافها. وقد أدى ذلك لإثبات أن الذرة يمكن أن تنقسم. كما ساهمت اكتشافات راذرفورد في إثبات وجود النواة وأنها تحمل شحنة موجبة. وكل الدراسات الحديثة للذرة تأخذ في الاعتبار أن الذرة تتكون من جسيمات تحت ذرية.
ومنذ عهد ديموقراطس تم اقتراح نظرات عديدة لتركيب الذرة منها :
نظرية البودينج
نظرية الذرة المكعبة
تصور بوهر
التصور الموجي وهو التصور المقبول حاليا راجع تركيب الذرة.
وبينما تم إثبات خطأ نظرية ديموقراطس تماما، فإن كثير من النظريات الحديثة مبنية على أفكار مشابهه مثل الشكل والاهتزاز وهذه الأفكار تماثل خواص الجسيمات تحت الذرية.
أصل تسمية الذرة
يرجع أصل كلمة الذرة إلى الكلمة الإغريقية أتوموس، وتعنى غير قابل للانقسام. وحتى القرن 19 حيث تم عرض تصور بوهر كان الاعتقاد السائد أن الذرات جسيمات دقيقة للغاية وغير قابلة للانقسام.
الترميز
يشار عادة إلى ذرة بواسطة رمزها الكيميائي، متبوعا بعدد الكتلة A الذي يساوي عدد النوكليونات في الذرة موضوعا في أعلى ويسار الرمز.
مثال: كربون 12 وعدده الكتلي هو 12 يرمز له بالرمز 12 C {\displaystyle {}^{12}\mathrm {C} \,} {\displaystyle {}^{12}\mathrm {C} \,}ويمكن أيضا إتمام هذا الترميز باضافة العدد الذري Z - وهو 6 للكربون فإن عدد البروتونات في نواة الكربون هي 6؛ ويوضع العدد الذري Z في الجزء السفلي الأيسر من الرمز.
وهكذا يرمز للكربون-12 بـالرمز 6 12 C {\displaystyle {}_{\ 6}^{12}\mathrm {C} \,} {\displaystyle {}_{\ 6}^{12}\mathrm {C} \,}.
والكربون-12 هو النظير الأغلب في الكربون ، فهو موجود في الكربون بنسبة 98 %.
وإذا فتحنا مقالة الكربون سنجد فيها نظائر للكربون ، وهي :
الكربون-11 ورمزه 6 11 C {\displaystyle {}_{\ 6}^{11}\mathrm {C} \,} {\displaystyle {}_{\ 6}^{11}\mathrm {C} \,}ويتحلل سريعا ،
والكربون-13 ورمزه 6 13 C {\displaystyle {}_{\ 6}^{13}\mathrm {C} \,} {\displaystyle {}_{\ 6}^{13}\mathrm {C} \,}
والنظير الكربون-14 ورمزه 6 14 C {\displaystyle {}_{\ 6}^{14}\mathrm {C} \,} {\displaystyle {}_{\ 6}^{14}\mathrm {C} \,}.
وتلك تسمى نظائر الكربون وهي مشعة وتتحلل سريعا (فهم يختلفون بذلك في الخواص الفيزيائية): والمهم في نظائر الكربون أنها لها نفس الخواص الكيميائية .
المصادر
"ترجمة و معنى كلمة ذرة - قاموس المصطلحات - العربية"، dictionary.torjoman.com (باللغة الإنجليزية)، مؤرشف من الأصل في 27 يناير 2020، اطلع عليه بتاريخ 19 مارس 2019.
C.R. Nave (2006). HyperPhysics: Hydrogen Spectrum. Georgia State University. Accessed March 1st, 2008. نسخة محفوظة 12 أكتوبر 2018 على موقع واي باك مشين.
اقرأ أيضًا
مبدأ أوفباو
مبدأ استبعاد باولي
نموذج بور
هيكل دقيق
ثابت البناء الدقيق
إجمالي مرات مشاهدة الصفحة {بادي-يا}
0 0
1 0
2 10
3 0
4 0
5 0
6 0
7 0
8 0
9 0
10 0
11 0
12 0
13 0
14 0
15 0
16 0
17 0
18 0
19 0
20 0
21 0
22 0
23 0
24 0
25 0
26 0
27 0
28 0
29 10
1,059
أرشيف المدونة الإلكترونية b..y.b..y 522y
مجلد 1. و2.إحياء علوم الدين محمد بن محمد الغزالي ...
مجلد3.و 4. إحياء علوم الدين المؤلف : محمد بن محمد ...
مجلد 5.و6. إحياء علوم الدين محمد بن محمد الغزالي أ...
مجلد 7.و8.إحياء علوم الدين المؤلف : محمد بن محمد ا...
مجلد9.و10. إحياء علوم الدين المؤلف : محمد بن محمد ...
الفوائد المختارة على أشراط الساعة إعـــــداد أب...
النهاية في الفتن والملاحم لابن كثير
فضائل القران لابن كثير
اختصار علوم الحديث ابن كثير (الباعث الحثيث)
ج1.قصص الانبياء لابن كثير
ج2. قصص الانبياء لابن كثير
صحيح البخاري/كتاب الفتن .
البداية والنهاية/الجزء السابع/فصل قتل عثمان أول ال...
كتاب (الفتن والملاحم) --من اول خبر الأبلة ابن كثير
ذكر أنواع من الفتن وقعت، وستكثر وتتفاقم في آخر الز...
ذكر دنو الساعة واقترابها وأنها آتية لا ريب فيها، و...
ذكر زوال الدنيا وإقبال الآخرة +حديث الصور بطوله
حديث الصور بطوله + فصل (النفخ في الصور) + ذكر أمر...
الغاية في شرح الهداية في علم الرواية ابن الجزري / ...
جُزءٌ فيهِ تحرير الجواب عن ضرب الدَّواب للسخاوي
لقطة العجلان مما تمس إلى معرفته حاجة الإنسان الملك...
سلسلة في رحاب الدار الآخرة المؤلف الشيخ محمد حسان
سلسلة في رحاب الدار الآخرة المؤلف الشيخ محمد حسان ج2.
سلسلة في رحاب الدار الآخرة المؤلف الشيخ محمد حسان ج3.
سلسلة في رحاب الدار الآخرة المؤلف الشيخ محمد حسان ج4.
كل شيئ عن الذرة.
الشمس w الدابة والدخـــــــــــــــان والخسوف ال...
الحـشــر /الشيخ محمد حسان
الحسـاب للشيخ محمد حسان
القصاص للشيخ محمد حسان
الميـزان للشيخ محمد حسان
النفخ فى الصور للشيخ محمد حسان
الموت للشيخ محمد حسان
عــذاب القبـــر للشيخ محمد حسسان
تابع الحساب للشيخ م حسان
نزول عيسى بن مريم عليه السلام للشيخ محمد حسان
العلامات إلى ثلاثة أقسام : أولا : علامات صغرى وق...
علامات الساعة الكبرى {{ المسيح الدجال للشيخ محمد حسان
مجئ الرب جل جلاله يوم القيامة للشيخ محمد حسان
نفخة البعث للشيخ محمد حسان
---- ------ -------
المعلم الاول اعداد دار الوطن
مباحث في بعض مشاهد القيامة - دار بلنسية / د.خالد ب...
الاعتبار في ذكر الجنة والنار -دار ابن خزيمة المؤلف...
موجز الأخبار عن الجنة والنار إعـــــداد أبو خلاد ن...
تذكيُر عباد الله بفضلِ لا حولَ ولا قوةَ إلا بالله ...
أحوال النساء في الجنة المؤلف الشيخ سليمان الخراشي
المشتاقون إلى الجنة للعريفي
الأمثال في القرآن الكريم لابن القيم
زاد المعاد في هدي خير العباد لابن القيم ج1.و2.
زاد المعاد في هدي خير العباد لابن القيم ج3. وج4.
زاد المعاد في هدي خير العباد لابن القيم ج5. و6.
زاد المعاد في هدي خير العباد لابن القيم ج7. والاخير
الزهد والورع والعبادة المؤلف ابن قيم الجوزية
------------
كتاب المحلى المؤلف : أبو محمد علي بن أحمد بن سعيد ...
كتاب المحلي ج3. و :4. المحلى بن حزم الأندلسي القر...
ج5. وج6.كتاب : 5.المحلى المؤلف : أبو محمد علي بن أ...
مجلد 7. وج8. المحلي لابن حزم
مجلد 9.و10.المحلي لابن حزم
ج{ 11 و12}المحلى لابن حزم
مجلد 13. المحلى والاخير
------------------
المسيح الدجال.. ماهى الصورة الخلقية التى رسمتها لن...
ج1.وج2.كتاب : الفرج بعد الشدة
كتاب : الأمر بالاتباع والنهي عن الابتداع المؤلف : ...
كتاب:العبودية المؤلف : شيخ الإسلام ابن تيمية
كتاب:أخلاق أهل القرآن المؤلف : الآجري
كتاب : اجتماع الجيوش الإسلامية على غزو المعطلة وال...
تابع .كتاب : الفرج بعد الشدة المؤلف : القاضي أبو ع...
كتاب : الكبائر محمد بن عثمان الذهبي
تابع كتاب : الفرج بعد الشدة المؤلف : القاضي أبو عل...
اسماء الله الحسني
هل أكل الحرام وتناوله على أي وجه كان محرم ام جائز
الاستخراج في اصطلاح المحدثين !!
التحقق التاريخي لنزول سورة الطلاق
النهاية في الفتن والملاحم لابن كثير
تحقيق أحاديث الطلاق وبيان وجه الحق فيه
حمل القران الكريم صفحة القارئ مشاري راشد العفاسي
دليل المدونة منسقا/اخر تنسق b.dy.b.dy522.......
مجلد 1. و2.إحياء علوم الدين محمد بن محمد الغزالي ...
مجلد3.و 4. إحياء علوم الدين المؤلف : محمد بن محمد ...
مجلد 5.و6. إحياء علوم الدين محمد بن محمد الغزالي أ...
مجلد 7.و8.إحياء علوم الدين المؤلف : محمد بن محمد ا...
مجلد9.و10. إحياء علوم الدين المؤلف : محمد بن محمد ...
الفوائد المختارة على أشراط الساعة إعـــــداد أب...
النهاية في الفتن والملاحم لابن كثير
فضائل القران لابن كثير
اختصار علوم الحديث ابن كثير (الباعث الحثيث)
ج1.قصص الانبياء لابن كثير
ج2. قصص الانبياء لابن كثير
صحيح البخاري/كتاب الفتن .
البداية والنهاية/الجزء السابع/فصل قتل عثمان أول ال...
كتاب (الفتن والملاحم) --من اول خبر الأبلة ابن كثير
ذكر أنواع من الفتن وقعت، وستكثر وتتفاقم في آخر الز...
ذكر دنو الساعة واقترابها وأنها آتية لا ريب فيها، و...
ذكر زوال الدنيا وإقبال الآخرة +حديث الصور بطوله
حديث الصور بطوله + فصل (النفخ في الصور) + ذكر أمر...
الغاية في شرح الهداية في علم الرواية ابن الجزري / ...
جُزءٌ فيهِ تحرير الجواب عن ضرب الدَّواب للسخاوي
لقطة العجلان مما تمس إلى معرفته حاجة الإنسان الملك...
سلسلة في رحاب الدار الآخرة المؤلف الشيخ محمد حسان
سلسلة في رحاب الدار الآخرة المؤلف الشيخ محمد حسان ج2.
سلسلة في رحاب الدار الآخرة المؤلف الشيخ محمد حسان ج3.
سلسلة في رحاب الدار الآخرة المؤلف الشيخ محمد حسان ج4.
كل شيئ عن الذرة.
الشمس w الدابة والدخـــــــــــــــان والخسوف ال...
الحـشــر /الشيخ محمد حسان
الحسـاب للشيخ محمد حسان
القصاص للشيخ محمد حسان
الميـزان للشيخ محمد حسان
النفخ فى الصور للشيخ محمد حسان
الموت للشيخ محمد حسان
عــذاب القبـــر للشيخ محمد حسسان
تابع الحساب للشيخ م حسان
نزول عيسى بن مريم عليه السلام للشيخ محمد حسان
العلامات إلى ثلاثة أقسام : أولا : علامات صغرى وق...
علامات الساعة الكبرى {{ المسيح الدجال للشيخ محمد حسان
مجئ الرب جل جلاله يوم القيامة للشيخ محمد حسان
نفخة البعث للشيخ محمد حسان
---- ------ -------
المعلم الاول اعداد دار الوطن
مباحث في بعض مشاهد القيامة - دار بلنسية / د.خالد ب...
الاعتبار في ذكر الجنة والنار -دار ابن خزيمة المؤلف...
موجز الأخبار عن الجنة والنار إعـــــداد أبو خلاد ن...
تذكيُر عباد الله بفضلِ لا حولَ ولا قوةَ إلا بالله ...
أحوال النساء في الجنة المؤلف الشيخ سليمان الخراشي
المشتاقون إلى الجنة للعريفي
الأمثال في القرآن الكريم لابن القيم
زاد المعاد في هدي خير العباد لابن القيم ج1.و2.
زاد المعاد في هدي خير العباد لابن القيم ج3. وج4.
زاد المعاد في هدي خير العباد لابن القيم ج5. و6.
زاد المعاد في هدي خير العباد لابن القيم ج7. والاخير
الزهد والورع والعبادة المؤلف ابن قيم الجوزية
كتاب المحلى المؤلف : أبو محمد علي بن أحمد بن سعيد ...
كتاب المحلي ج3. و :4. المحلى بن حزم الأندلسي القر...
ج5. وج6.كتاب : 5.المحلى المؤلف : أبو محمد علي بن أ...
مجلد 7. وج8. المحلي لابن حزم
مجلد 9.و10.المحلي لابن حزم
ج{ 11 و12}المحلى لابن حزم
مجلد 13. المحلى والاخير
------------------
المسيح الدجال.. ماهى الصورة الخلقية التى رسمتها لن...
ج1.وج2.كتاب : الفرج بعد الشدة
كتاب : الأمر بالاتباع والنهي عن الابتداع المؤلف : ...
كتاب:العبودية المؤلف : شيخ الإسلام ابن تيمية
كتاب:أخلاق أهل القرآن المؤلف : الآجري
كتاب : اجتماع الجيوش الإسلامية على غزو المعطلة وال...
تابع .كتاب : الفرج بعد الشدة المؤلف : القاضي أبو ع...
كتاب : الكبائر محمد بن عثمان الذهبي
تابع كتاب : الفرج بعد الشدة المؤلف : القاضي أبو عل...
اسماء الله الحسني
هل أكل الحرام وتناوله على أي وجه كان محرم ام جائز
الاستخراج في اصطلاح المحدثين !!
التحقق التاريخي لنزول سورة الطلاق
النهاية في الفتن والملاحم لابن كثير
تحقيق أحاديث الطلاق وبيان وجه الحق فيه
حمل القران الكريم صفحة القارئ مشاري راشد العفاسي
ب بادي با
الطلاق للعدة ما هو؟ /علامات القيامة /تعاليات إيمانية
مجلد 1 من 13 .كتاب :1- المحلى أبو محمد علي بن أحم... /مجلد 2. من 13.{الكتاب : المحلى مجلد 2 .} لابن حزم /ملد 3. من 13. مجلد {كتاب :3. المحلى المؤلف : أبو م...
انظر مدونة منصة الحاكم النيسابوري
]
تعقيب الذهبي في (التلخيص) لما صححه الحاكم مسند قوي... /مسألة التحمل الخبري والاداء الخبري /المنهج العلمي الصحيح لتحمل الاخبار والاحاديث ثم أد... /شروط نقل الخبر النبوي يشترط فيه ان تكون سلسلة التح... /ترجمة أبو عبد الله الحاكم محمد بن عبد الله بن محمد... /أبو عبد الله الحاكم النيسابوري 2. /ترجمة المؤلف الحاكم النيسابوري مفصلة اهم ترجمة 5. /انضج /ترجمة للحاكم 6.{ترجمة المؤلف الحاكم النيسابور... /ج1}صفحة نقد صابر مشهور/ ترجمة المؤلف الحاكم الني//مدونة الاصابة /الطلاق للعدة ما هو؟ /علامات القيامة /مستدرك الحاكم /تعاليات إيمانية
من أنا
 -- عرض الملف الشخصي الكامل الخاص بي
-- عرض الملف الشخصي الكامل الخاص بي